ASMD (Morbus Niemann-Pick Typ A, A/B & B)(Saure Sphingomyelinase-Mangel)
Was ist ASMD?
ASMD (engl. Acid Sphingomyelinase Deficiency, dt. Saure Sphingomyelinase-Mangel) zählt zu den lysosomalen Speicherkrankheiten und kann sowohl bei Kindern als auch Erwachsenen auftreten. Sie ist eine seltene, fortschreitende Erkrankung, die potenziell lebensbedrohlich ist.1,2,3
Im Zusammenhang mit ASMD finden sich auch Begriffe wie Morbus Niemann-Pick, Niemann-Pick-Krankheit, Niemann-Pick-Syndrom oder Niemann Pick Disease. Diese Bezeichnungen gehen zurück auf den Kinderarzt Albert Niemann, der 1914 als erster einen Fall beschrieb, sowie den Pathologen Ludwig Pick, der die Erkrankung 1926 vom symptomatisch ähnlichen Morbus Gaucher abgrenzte.
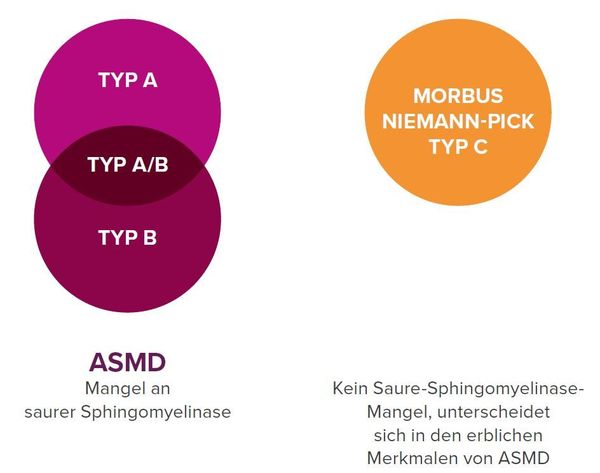
Früher wurden drei Erkrankungen unter Morbus Niemann-Pick zusammengefasst: Typ A, Typ B und Typ C. Mittlerweile ist bekannt, dass Typ A und Typ B durch einen Mangel an saurer Sphingomyelinase entstehen. Typ C hat jedoch eine andere Ursache, hier kann der Körper Cholesterin und weitere Fettstoffe nicht richtig abbauen.4
Mit dieser Erkenntnis wird heute nach der Krankheitsursache unterschieden und benannt: ASMD (früher Morbus Niemann-Pick Typ A, A/B & B) und Morbus Niemann-Pick Typ C.4
Auf dieser Website erfahren Patient*innen, ihre Angehörigen und Interessierte Wissenswertes über die seltene Erkrankung ASMD (Morbus Niemann Pick Typ A, A/B & B), die durch einen Mangel an saurer Sphinogomyelinase entsteht. Hier erhalten Sie Antworten auf die wichtigsten Fragen:
- Was ist ASMD und welche Typen gibt es?
- Was für Anzeichen deuten auf ASMD hin?
- Was ist die genaue Ursache von ASMD?
- Wie wird ASMD diagnostiziert?
Die Ursache von ASMD ist ein Aktivitätsmangel des Enzyms saure Sphingomyelinase: ein Enzym, das für den Abbau des Fettstoffs Sphingomyelin zuständig ist.3,5 Dieser Mangel führt zur Ansammlung von Sphingomyelin in Lunge, Milz, Leber, Knochen und in schweren Fällen im zentralen Nervensystem.1,2,3
ASMD wird autosomal-rezessiv vererbt. Das bedeutet, beide Elternteilen müssen Träger einer Veränderung des SMPD1-Gens sein, sie müssen jedoch nicht selbst betroffen sein. Dieses SMPD1-Gen enthält den Bauplan für die saure Sphingomyelinase.2,3
Die lysosomale Speichererkrankung ASMD ist mit einer geschätzten Häufigkeit bei der Geburt von 0,4 bis 0,6/100.000 Einwohner sehr selten. Männer und Frauen sind gleichermaßen betroffen. Der ASMD Typ A kommt bei Menschen mit Ashkenazi-jüdischer Abstammung häufiger vor als in der Allgemeinbevölkerung.4
Die Diagnose wird meist sehr verzögert gestellt: Bei Typ B vergehen im Schnitt 5 Jahre.6 ASMD kann mit anderen, häufigeren Krankheiten, seltenen Krankheiten mit ähnlichen Symptomen oder anderen lysosomalen Speichererkrankungen – Morbus Gaucher, LAL-D oder Morbus Niemann-Pick Typ C – verwechselt werden.3 Eine frühe Diagnose mit anschließender Behandlung der Symptome ist jedoch wichtig. Sie kann dazu beitragen, die Lebensqualität zu verbessern und Unsicherheiten zu beseitigen.4,7
Welche Typen von ASMD gibt es?
Bei ASMD (engl. Acid Sphingonmyelin Deficiency, dt. Saure Sphingomyelinase-Mangel) handelt es sich um ein Erkrankungsspektrum, das in drei Subtypen unterteilt wird. Die Übergänge zwischen den einzelnen Typen sind fließend. Am häufigsten ist Typ B, bei dem die Symptome auch erst im Erwachsenenalter auftreten.8 Über die drei ASMD-Typen informiert zu sein, kann Ihnen und Ihrem/Ihrer Ärzt*in dabei helfen, über die Symptome zu sprechen und sie besser zu verstehen.
Merkmale der unterschiedlichen ASMD-Typen
Typ A3,9
Erstes Auftreten von Symptomen
kurz nach Geburt oder in den ersten Lebensmonaten
Beteiligte Organe
betrifft mehrere wichtige Organe im Körper, einschließlich Gehirn und zentrales Nervensystem
Fortschreiten
schnell
Schwere der Erkrankung
am schwerwiegendsten
Anzeichen und Symptome
- Vergrößerung von Leber (Hepatomegalie) und Milz (Splenomegalie)
- Entwicklungsverzögerung
- Atemwegsinfekte, Lungenerkrankungen
- Reizbarkeit
- Schlafstörungen
- Zunehmende Muskelschwäche
- Kirschroter Fleck im Auge
Verlauf
infantil neuroviszeral
Lebenserwartung
ca. 3 Jahre
Häufige Todesursachen
Lungenerkrankung, Komplikationen durch Blutungen
Typ A/B10,11
Erstes Auftreten von Symptomen
Säuglingsalter bis Kindheit
Beteiligte Organe
betrifft mehrere wichtige Organe im Körper, möglicherweise auch Gehirn und zentrales Nervensystem
Fortschreiten
variiert
Schwere der Erkrankung
intermediär
Anzeichen und Symptome
- Verzögertes Wachstum und verzögerte Pubertät
- Vergrößerung von Leber (Hepatomegalie) und Milz (Splenomegalie)
- Fettstoffwechselstörung, Herzklappenerkrankung, Erkrankung des Arteriensystems (Arteriosklerose)
- Verminderte Anzahl von Blutplättchen (Thrombozytopenie)
- Lungenerkrankung
- Lebererkrankung
Verlauf
chronisch neuroviszeral
Lebenserwartung
variiert zwischen Kindes- und frühem Erwachsenenalter
Häufige Todesursachen
Lungenerkrankung, Lebererkrankung
Typ B6,10,12
Erstes Auftreten von Symptomen
kann in jedem Alter auftreten
Beteiligte Organe
betrifft mehrere wichtige Organe im Körper, jedoch nicht das Gehirn, geringe bis keine Beteiligung des zentralen Nervensystems
Fortschreiten
langsam
Schwere der Erkrankung
am wenigsten ausgeprägt
Anzeichen und Symptome
- Vergrößerung von Leber (Hepatomegalie) und Milz (Splenomegalie)
- Blutungen
- Lungenerkrankungen
- Kurzatmigkeit
- Gelenk- und Gliederschmerzen
- Verminderte Knochendichte (Osteopenie) und Knochenschwund (Osteoporose)
- Verzögertes Wachstum in der Jugend
- Verminderte Anzahl von Blutplättchen (Thrombozytopenie)
- Fettstoffwechselstörung
Verlauf
chronisch viszeral
Lebenserwartungen
Erreichen des Erwachsenenalters
Häufige Todesursachen
Lungenerkrankung, Lebererkrankung
Klicken Sie hier, um das Video zu laden. Es werden Daten an den Anbieter übermittelt und Cookies gesetzt! Mehr dazu in der Datenschutzerklärung.
1. Symptome bei ASMD
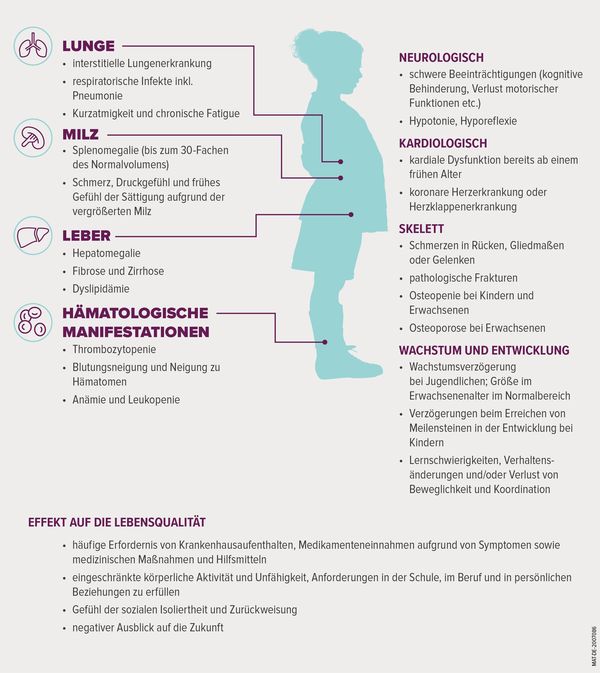
ASMD kann viele Organe und Körperfunktionen betreffen – die genaue Ausprägung der Symptomatik kann bei ASMD-Patient*innen unterschiedlich sein. Bei den ASMD-Typen A/B und B schreitet die Erkrankung weniger schnell voran als bei Typ A. Die folgenden Anzeichen und Symptome können bei allen Subtypen in unterschiedlichen Kombinationen auftreten:13,7
1.1 ASMD Typ A5,8 (Morbus Niemann-Pick Typ A)
Bei ASMD Typ A reichert sich Sphingomyelin hauptsächlich im Gehirn an. Das wirkt sich auf das zentrale Nervensystem, sowie Leber, Milz und Lunge aus. Eine Vergrößerung von Leber und Milz (Hepatosplenomegalie) ist meist das erste festgestellte Anzeichen und tritt in der Regel im frühen Säuglingsalter von 6 bis 9 Monaten auf.
Ein betroffenes Baby entwickelt sich zunächst normal und unauffällig. Dann folgt eine Phase des Entwicklungsstillstands. Anschließend verliert der Säugling bereits erlernte Fähigkeiten wieder. Weitere wichtige Merkmale sind eine zunehmende Muskelschwäche, Ernährungsschwierigkeiten, Gelbsucht und Gedeihstörung. Typisch ist auch ein kirschroter Fleck im Auge.
1.2 ASMD Typ A/B9,10 (Morbus Niemann-Pick Typ A/B)
Die Vergrößerung von Leber und Milz sowie eine Beteiligung der Lunge zeigt sich auch bei Patient*innen mit ASMD Typ A/B. Die Beteiligung des zentralen Nervensystems kann unterschiedlich stark ausgeprägt sein. Auch das Fortschreiten der Erkrankung kann bei Typ A/B unterschiedlich ausfallen. Bei Erkrankungsbeginn im Kindesalter sind verzögertes Wachstum und verspätete Pubertät typisch.
1.3 ASMD Typ B7,9,11 (Morbus Niemann-Pick Typ B)
Auch bei Patient*innen mit Typ B tritt eine Vergrößerung von Leber und Milz sowie eine Lungenbeteiligung ein. Eine Beteiligung des zentralen Nervensystems ist bei Typ B nicht oder nur geringfügig gegeben. Dieser ASMD-Subtyp schreitet langsamer als beispielsweise Subtyp A voran. Bei Erkrankungsbeginn im Kindesalter sind, wie bei Typ A/B, verzögertes Wachstum und verspätete Pubertät typisch.
1.4 Anzeichen und Symptome von ASMD im Einzelnen
ASMD betrifft am häufigsten Milz, Leber, Lunge, Blut und Verdauungssystem. Hinweise können sein:13,11
- Hervorstehender Bauch aufgrund vergrößerter Leber und/oder Milz
- Husten und Atembeschwerden
- Neigung zu Blutergüssen und Blutungen
- Bauchschmerzen und Durchfall
1.4.1 Milz und Leber
Eine Vergrößerung von Milz und/oder Leber gehört zu den ersten Symptomen von ASMD und tritt bei fast allen Patient*innen auf. Ein ungewöhnlich dicker Bauch kann bei Säuglingen und Kleinkindern ein Hinweis auf eine Vergrößerung von Milz und/oder Leber sein. Bei älteren Patient*innen können (Ober-) Bauchbeschwerden und/oder Völlegefühl auftreten.13,8

- Mehr als 90% der Patient*innen zeigen eine vergrößerte Milz (Splenomegalie), die teils ein Vielfaches ihres Volumens einnimmt.13

- Über 70% haben eine vergrößerte Leber (Hepatomegalie).8
- Bei Patient*innen mit Typ A/B oder B tritt im Verlauf dann häufig eine Vernarbung der Leber (Fibrose) ein. Diese kann sich verschlimmern und zu einer Zirrhose werden, was zu weiteren Komplikationen führen kann.8
1.4.2 Lunge
Die meisten ASMD-Patient*innen haben eine eingeschränkte Lungenfunktion.

- Bei über 80% der Patient*innen wird eine Lungenerkrankung festgestellt. Es kommt zu Atembeschwerden, Husten und Infektionen wie Lungenentzündung. 4,13
1.4.3 Blut
Auch das Blut ist sehr häufig von ASMD betroffen.

- Eine verminderte Anzahl an Blutplättchen (Thrombozytopenie) führt bei mehr als der Hälfte aller Patient*innen zu einer Neigung zu Blutergüssen und Blutungen (z.B. häufiges Nasenbluten, starke oder langanhaltende Regelblutungen, Blutungen nach operativen Eingriffen etc). 13
- Starke Blutungen können lebensbedrohlich sein.13
- Bei je einem Viertel aller Patient*innen kommt es zu einer Abnahme der roten Blutkörperchen (Anämie) oder der weißen Blutkörperchen (Leukopenie). Dies kann sich in starker Müdigkeit (Fatigue) äußern.13
1.4.4 Magen und Verdauungssystem
Störungen des Magen- und Verdauungstrakts zählen zu den häufigsten Anzeichen für ASMD.
- Drei Viertel der Patient*innen leiden an Problemen mit dem Magen- und Verdauungssystem. Speziell bei den Typen A/B und B treten Bauchschmerzen und Unwohlsein sowie Durchfall auf.4
1.4.5 Gehirn und Nervensystem
Vor allem die Typen A und A/B zeigen eine Beteiligung des Nervensystems.
- Patient*innen mit ASMD Typ A zeigen eine schwere Beteiligung des Nervensystems13
- Erste neurologische Symptome treten in der Regel im Alter von 6 Monaten auf.
- Es kommt zu Entwicklungsstörungen, die Entwicklung stoppt meist im Alter von 10 Monaten.
- Kinder verlernen bereits erworbene Fähigkeiten (Verhalten, Sprache, Fein- und Grobmotorik) wieder.
- Ein Verlust von Reflexen sowie ein Mangel an Muskelstärke und Muskelspannung (muskuläre Hypotonie) ist zu beobachten.
- Aufgrund von Nervenschäden (Neuropathie) entwickeln sich Taubheitsgefühl und Kribbeln in den Händen und Füßen.
- Beim Typ A/B schreitet die Beteiligung des Nervensystems langsamer voran als bei Typ A4
- Das Gleichgewicht und die Koordination (Ataxie) sind beeinträchtigt.
- Die motorische Entwicklung ist deutlich verzögert.
- Lernschwierigkeiten treten auf.
- Patient*innen mit ASMD Typ B zeigen nur eine geringfügige oder gar keine Beteiligung des Nervensystems, ein Untergang von Nervenzellen wird nicht beobachtet.4
1.4.6 Augen
Die Augen sind vor allem bei den Typen A und A/B betroffen.4
- Im Verlauf der Erkrankung entwickeln Patient*innen einen kirschroten Fleck im Auge (kirschrote Makula).
1.4.7 Herz und Blutgefäße
Symptome, die das Herz-Kreislauf-System betreffen, treten vor allem bei den Typen A/B und B auf.4
- An den Blutgefäßen des Herzens entstehen Schäden.
- Auf dem EKG (Elektrokardiogramm) kann ein anormaler Herzschlag gesehen werden.
- In der Regel bestehen bei den Patient*innen von klein auf Herzprobleme.
- Die Patient*innen zeigen ungewöhnliche Cholesterinspiegel (Dyslipidämie).
1.4.8 Knochen und Gelenke
Viele Patient*innen mit chronischen Verläufen von ASMD, also Typ A/B und Typ B, erfahren Schmerzen in Knochen und Gelenken.4
- Vorwiegend treten Rücken-, Bein-, Arm- und/oder Gelenkschmerzen auf.
- Oftmals führt eine Knochenschwäche (Osteopenie/Osteoporose) zu häufigen Knochenbrüchen.
1.4.9 Wachstum und Entwicklung
Ein Merkmal von ASMD ist eine verzögerte Knochenreifung sowie ein eingeschränktes Wachstum in der Kindheit.4,13
- Bei den Kindern sind eine Wachstumsverzögerung und Entwicklungsverzögerungen feststellbar.
- Typisch ist auch eine verzögerte Pubertät.
- Zu beobachten ist ein Verlust der Beweglichkeit und der Koordination.
1.4.10 Chronische Müdigkeit
ASMD geht in vielen Fällen mit chronischer Müdigkeit einher.
- Die Patient*innen sind anhaltend müde, erschöpft und antriebslos (Fatigue).
- Die chronische Müdigkeit erschwert neben den körperlichen Symptomen zusätzlich den Alltag.
2. Vererbung von ASMD
2.1 Ist ASMD vererbbar?
ASMD ist eine Erbkrankheit, die durch genetische Varianten (Veränderungen in den Genen) verursacht wird. Diese Veränderungen können bestimmte Prozesse im Körper verändern und zu Krankheiten führen. Das an ASMD beteiligte Gen heißt SMPD1.4
2.2 Wie sieht der Erbgang bei ASMD aus?
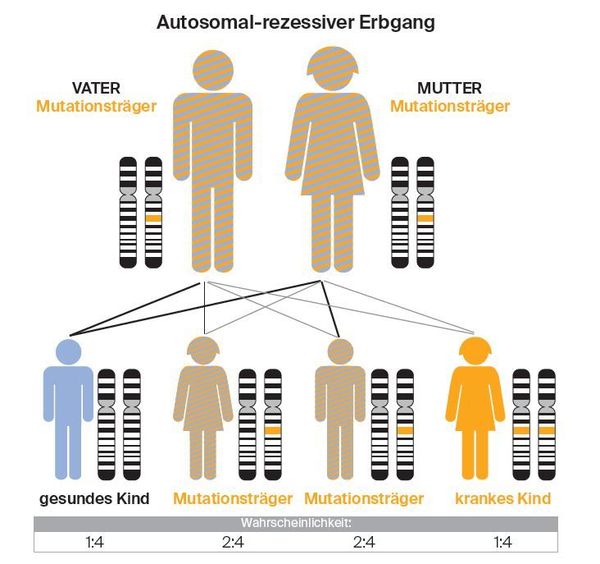
Die lysosomale Speicherkrankheit ASMD wird autosomal-rezessiv vererbt. Das heißt, dass ein Kind an ASMD erkrankt, wenn es von beiden Elternteilen ein verändertes Gen geerbt hat.
Sind beide Elternteile Träger einer Veränderung des Gens, haben Geschwister eines/einer ASMD-Patient*in eine
- 25-prozentige Wahrscheinlichkeit, gesund und kein/keine Überträger*in zu sein,
- 50-prozentige Wahrscheinlichkeit, nicht zu erkranken, aber Überträger*in der Erkrankung zu sein,
- 25-prozentige Wahrscheinlichkeit selbst zu erkranken.
Auch die Geschwister der beiden betroffenen Elternteile haben eine 50-prozentige Wahrscheinlichkeit, dass sie selbst Überträger*in von ASMD sind.
2.3 Was sollten Familienangehörige bzw. Geschwister eines/einer neu diagnostizierten ASMD-Patient*in tun?
Wird bei einem Familienmitglied die Diagnose ASMD (Niemann-Pick Typ A, A/B & B) gestellt, können Angehörige eine sogenannte genetische Beratung in Anspruch nehmen. Bei genetischen Beratungsstellen kann geklärt werden, wer ebenfalls die erblich bedingte Erkrankung bekommen kann. Geschwister sollten sich auf jeden Fall testen lassen. Die Ergebnisse sind eine wichtige Entscheidungshilfe für eventuell notwendige Behandlung oder auch für die weitere Familienplanung.
3. Diagnostik bei ASMD
3.1 Was sind typische Symptome für ASMD?
Bestimmte Anzeichen legen den Verdacht auf ASMD nahe. Das erste auftretende Symptom ist meist eine Vergrößerung von Leber und/oder Milz. Dies äußert sich durch einen ungewöhnlich dicken Bauch. Husten und Atembeschwerden, Neigung zu Blutergüssen und Blutungen, Bauchschmerzen und Durchfall sind ebenfalls Hinweise auf ASMD.
3.2 Welche Untersuchungen sind für die Diagnostik von ASMD nötig?
ASMD ist eine lysosomale Speichererkrankung, die durch einen Mangel an Aktivität des Enzyms saure Sphingomyelinase (ASM, acid sphingomyelinase) entsteht. Ein Bluttest, der misst, wieviel funktionsfähige ASM im Blut ist, ermöglicht eine sichere ASMD-Diagnose. Eine zusätzliche Bestätigung kann durch Gentests erfolgen.
Da es durch den Mangel an Aktivität von saurer Sphingomyelinase zu Veränderungen in Milz, Leber, Lunge, Blut und Verdauungssystem kommen kann, kann der/die Ärzt*in neben dem Bluttest noch weitere Untersuchungen veranlassen:
- Ultraschalluntersuchung: So können die Vergrößerungen von Leber und/oder Milz gemessen werden.
- Röntgenaufnahmen/Computertomographie: Anhand der bildgebenden Verfahren können Erkrankungen der Lunge festgestellt werden.
- Lungenfunktionstests: Dieser Test dient der Diagnose von Erkrankungen der Lunge und der Atemwege.
Invasive Testverfahren wie Knochenmarkbiopsien sind für eine Bestätigung der ASMD-Diagnose nicht erforderlich.
3.3 Weshalb ist eine frühe Diagnose von ASMD wichtig für Sie oder Ihre Angehörigen?
Eine frühzeitige Diagnose von ASMD ist wichtig, damit schnellstmöglich eine Behandlung der Symptome eingeleitet werden kann.4 Ferner ist ein Familien-Screening sinnvoll. Ein frühes Erkennen der Erkrankung kann dazu beitragen, die Lebensqualität zu verbessern und Unsicherheiten zu beseitigen.4,14
3.4 Wie geht der/die Ärzt*in bei Verdacht auf ASMD vor?
ASMD ist eine Krankheit, die viele Organe betrifft und die Lebensdauer verkürzen kann.13 Typische Anzeichen, die sowohl bei Kindern als auch Erwachsenen auftreten können, sind eine Vergrößerung der Leber und/oder Milz, eine verminderte Anzahl an Blutplättchen sowie eine Lungenfunktionsstörung.13 Treten typische Symptome bei Ihnen auf, wird Ihr/Ihre Ärzt*in einen Trockenbluttest durchführen, um ASMD zu diagnostizieren. Das ist eine Blutuntersuchung zur Messung der Menge an Enzymaktivität von ASM (engl. acid sphingomyelinase, dt. Saure Sphingomyelinase). Die Diagnose ASMD kann bestätigt werden, wenn der Test eine verminderte ASM-Enzymaktivität zeigt. Mithilfe dieses Tests kann auch eine Abgrenzung von Morbus Gaucher, einer symptomatisch ähnlichen lysosomalen Speicherkrankheit, erfolgen.7,13
3.5 Wie bzw. mit welchem Test kann ASMD nachgewiesen werden?
Besteht bei Ihnen oder einem/einer Angehörigen der Verdacht auf die seltene Erkrankung ASMD, kann dieser recht einfach mit einer Blutuntersuchung überprüft werden. Die empfohlene Methode zur Diagnose von ASMD ist ein sogenannter Trockenbluttest. Damit lässt sich die Enzymaktivität von ASM (engl. acid sphingomyelinase, dt. saure Sphingomyelinase) messen. Die Verdachtsdiagnose ASMD kann bestätigt werden, wenn der Test eine verminderte ASM-Enzymaktivität ergibt.
Neben einem Test nur für ASMD gibt es auch einen Trockenblut-Multitest. Mit diesem kann zusätzlich auf Morbus Gaucher und LAL-D (Lysosomaler saurer Lipase-Mangel) getestet werden. Die beiden Erkrankungen zählen ebenfalls zu den lysosomalen Speicherkrankheiten und weisen eine teilweise ähnliche Symptomatik auf. Ein gemeinsamer Test auf alle drei Erkrankungen ist daher sinnvoll.
3.6 Wie funktioniert der Trockenbluttest bei ASMD?
Zur Bestimmung der Enzymaktivität der sauren Sphingomyelinase wird Ihnen bei Ihrem/Ihrer Ärzt*in Blut abgenommen. Das Blut wird jedoch nicht, wie Sie es sonst kennen, in Röhrchen ins Labor geschickt. Für den Trockenbluttest werden einige Tropfen Blut auf eine spezielle Filterkarte, die Trockenblutkarte, getropft und an der Luft trocknen gelassen. Die Karte wird dann per Post in ein Labor geschickt. Im Labor wird das Blut wieder aus der Karte herausgelöst und mittels moderner Verfahren getestet.
3.7 Kann ASMD auch durch einen Gentest nachgewiesen werden?
Es gibt Veränderungen in den Genen, von denen bekannt ist, dass sie ASMD auslösen und auch welchen Typ von ASMD. Werden solche Veränderungen bei einem Gentest nachgewiesen, ist damit auch die Diagnose ASMD gesichert.
Allerdings gibt es auch genetische Veränderungen, bei denen nicht klar ist, ob sie tatsächlich zu einer Erkrankung führen. In solch einem Fall reicht ein Gentest allein für die Diagnose nicht aus. Dann muss noch ein Nachweis über eine verminderte Aktivität des Enzyms ASM erfolgen, um ASMD zu diagnostizieren.
3.8 Warum ist es sinnvoll, dass Ihr/Ihre Ärzt*in Sie nach Erkrankungen Ihrer näheren Verwandten (Eltern, Geschwister) fragt? Können diese auch betroffen sein?
ASMD ist eine Erbkrankheit, die Eltern an ihre Kinder weitergeben können – auch wenn die Eltern kein ASMD haben. Daher kann es sein, dass noch ein weiteres Familienmitglied von der Krankheit betroffen ist. Ein Familien-Screening auf ASMD kann helfen, schneller zu einer Diagnose zu gelangen, damit die Symptome frühzeitig behandelt werden können.
3.9 Welcher/Welche Ärzt*in ist bei einem Verdacht auf ASMD der/die richtige Ansprechpartner*in?
Sollten Sie Symptome haben, die den Verdacht nahelegen, dass deren Ursache ASMD ist, suchen Sie bitte Ihren/Ihre Hausärzt*in/Kinderärzt*in auf und sprechen Sie ihn/sie auf Ihren Verdacht an. Da die Erkrankung sehr selten ist, sind nur wenige Ärzt*innen mit ASMD vertraut. Daher wird Ihr/Ihre Hausärzt*in/Kinderärzt*in Sie an ein spezialisiertes Zentrum überweisen.
In solchen spezialisierten Zentren und Kliniken sind Ärzt*innen, die über umfangreiche Erfahrung und Wissen in der Diagnostik und Behandlung von Patient*innen mit ASMD verfügen.
4. Erkrankungen mit ähnlichen Symptomkonstellationen wie ASMD
Viele Symptome von ASMD ähneln denen anderer Erkrankungen, wie z.B. Blutkrebs, Erkrankungen des Herzens oder der Lunge. Bestimmte ASMD-Symptome überschneiden sich auch mit der Gaucher-Krankheit, einer weiteren seltenen Erbkrankheit, die sich mit der Zeit verschlimmern kann.
Verzögerungen bei der Diagnose sind aufgrund dieser Symptomüberlappung zwischen ASMD und anderen Erkrankungen häufig. Ihr/Ihre Äzt*in kann auf andere Krankheiten testen, um sicherzustellen, dass Sie eine genaue Diagnose erhalten.
Symptomatisch ähnliche Erkrankungen, mit denen ASMD verwechselt werden kann:
10,13,15,16,17,18,19,20,21,22
Vergrößerung | Lungen erkrankung | Vergrößerung | Verminderte | |
|---|---|---|---|---|
ASMD | >90% | >80% | >70% | >50% |
Morbus | x | x | x | x |
Blutkrebs | x |
| x | x |
Tumore des | x | x | x | x |
Leberentzündung | x |
| x | x |
Herzschwäche |
| x | x |
|
Mukoviszidose |
| x | x |
|
Niemann-Pick | x |
| x |
|
Saurer |
|
| Lebererkrankung |
|
5. Therapie bei ASMD
Die Erkrankung ASMD (Typ A/B & B) kann behandelt werden. Für weitere Informationen wenden Sie sich gerne an Ihren/Ihre behandelnden/behandelnde Ärzt*in oder an ein ASMD-Kompetenzzentrum in Ihrer Nähe.
6. ASMD Zentren in Deutschland
Wenn Sie den Verdacht haben, dass Sie – oder eventuell auch Ihr Kind – an ASMD erkrankt sein könnten, sollten Sie sich an einen/eine Ärzt*in Ihres Vertrauens wenden.
Auf Grund der Symptomatik sind bestimmte Fachärzt*innen wie Pädiater*innen, Hämatolog*innen, Gastroenterolog*innen oder Pneumolog*innen gute Ansprechpartner*innen.
Allerdings ist ASMD so selten, dass nicht auf diese Erkrankung spezialisierte Ärzt*innen möglicherweise selbst erst einmal nachschlagen müssen.
Derzeit gibt es eine wachsende Anzahl an Zentren mit spezialisierten Ärzt*innen, die Expert*innen auf dem Gebiet ASMD sind. Diese Kompetenzzentren verfügen über umfangreiches Fachwissen und sind untereinander gut vernetzt.
Hinweis:
Die auf dieser Website befindliche Liste von spezialisierten Kliniken bzw. Zentren ist nicht abschließend. Bislang nicht aufgeführte Zentren können jederzeit ergänzt werden.
oder
Literatur
1 Desnick JP et al. Mol Med. 2010;16:316-321.
2 Schuchman EH. J Inherit Metab Dis. 2007;30:654-663.
3 Wasserstein MP, University of Washington, Seattle, 2006. http://www.ncbi.nlm.nih.gov/books/NBK1370/
4 McGovern MM et al. Genet Med 2017; 19: 967-974.
5 Schuchman EH, Desnick RJ. In: The Online Metabolic and Molecular Basis of Inherited Disease. DOI:10.1036/ommbid.174.
6 McGovern MM et al. Pediatrics. 2008;122:e341-e349.
7 Henderson SL et al. Am J Med Genet A 2009; 149A: 2430-2436.
8 Wasserstein M et al. Mol Genet Metab 2019; 126: 98-105.
9 McGovern MM, et al. Neurology 2006;66:228-232.
10 McGovern MM et al. Genet Med. 2013;15:618-623.
11 Cox GF, et al. JIMD Rep 2018;41:119-129.
12 Wasserstein MP et al. Pediatrics. 2004;114:e672-e677.
13 McGovern MM, et al. Orphanet J Rare Dis. 2017;12:41. doi:10.1186/s13023-017-0572-x.
14 Henderson SL et al. Am J Med Genet A 2009; 149A: 2430-2436.
15 Grabowski GA, et al. Eur J Pediatr. 2004;163(2):58-66. doi:10.1007/s00431-003-1362-0.
16 Larson RA, Anastasi J. In: Estey EH, Faderl SH, Kantarjian HM, eds. Hematologic Malignancies: Acute Leukemias. Heidelberg, Germany: Springer-Verlag; 2008:109-118.
17 Freedman A. Am J Hematol. 2018;93(2):296-305. doi:10.1002/ajh.24937.
18 Shankland KR, Armitage JO, Hancock BW. Lancet. 2012;380(9844):848-857. doi:10.1016/S0140-6736(12)60605-9.
19 Liang JT. Hepatology. 2009;49(suppl 5):S13-S21. doi:10.1002/hep.22881.
20 Watson RDS, et al. BMJ. 2000;320(7229):236-239.
21 Kobelska-Dubiel N, Ket al. Prz Gastroenterol. 2014;9(3)136-141. doi:10.5114/pg.2014.43574.
22 Naehrig S, et al. Dtsch Arztebl Int. 2017;114(33-34):564-574.
MAT-DE-2005996
MAT-DE-2102783
MAT-DE-2202903
Viele interessante Informationen rund um die Erkrankung ASMD finden Sie als Angehöriger der Fachkreise ab sofort neu auf „Campus Sanofi“.
(Aktualisierung November 2023)