Basis des Fortschritts in der Medizin: Biotechnologie
Prof. Dr. Theodor Dingermann, Direktor des Instituts für Pharmazeutische Biologie der Johann Wolfgang Goethe-Universität, Biozentrum, Frankfurt a. M.
Was wäre unser Gesundheitswesen ohne unsere Medikamente? Aus heutiger Sicht ist das unvorstellbar. Dabei haben viele von uns den Fortschritt bei der Arzneimittelentwicklung tatsächlich miterlebt. Kaum registrieren wir, in welchem Ausmaß bestimmte Todesursachen in den letzten 40 Jahren zurückgegangen sind:
Die Säuglingssterblichkeit sank um 80%, Tod durch rheumatisches Fieber oder rheumatische Herzerkrankungen gingen jeweils um 75% zurück, an Atherosklerose und Bluthochdruck sterben heute 70% weniger als noch 1965, Magen- und Zwölffingerdarmgeschwür als Todesursache ging um 60% zurück und an infarktbedingten Herzerkrankungen versterben heute 40% weniger als vor 40 Jahren. All dies haben wir fast ausschließlich innovativen und hochpotenten Arzneimitteln zu verdanken.
Was sind Arzneimittel?
Was sind das für Substanzen, die so unglaublich erfolgreich bei lebensbedrohlichen Krankheiten eingesetzt werden? Gemeinsam ist diesen Substanzen, dass sie mit Molekülen in unserem Körper interagieren und Fehlfunktionen korrigieren.
- Entweder „bremsen“ sie überaktive Biomoleküle, z. B. bei stechenden Kopfschmerzen.
- Oder sie „aktivieren“ Biomoleküle, die in ihrem zu trägen Zustand beispielsweise die Parkinson’sche Krankheit verursachen.
- Schließlich befindet sich in unserem Arzneimittelschatz eine kleine Gruppe von Substanzen, die fehlende Funktionen im Körper ersetzen.
Verschiedene Klassen von Arzneimitteln
Die Vertreter der ersten beiden Gruppen – also die Bremser und die Aktivatoren – sind relativ kleine Moleküle. Sie ahmen nicht etwa die Funktion komplexer Biomoleküle nach, sondern steuern nur deren Aktivität. Diese Substanzen können mit den Methoden der klassischen Chemie hergestellt werden. Ganz anders verhält es sich mit den Arzneistoffen, die eine fehlende Funktion im Organismus ersetzen. Dies sind Moleküle wie Insulin, das zur Behandlung der Zuckerkrankheit lebensnotwendig ist, oder Gerinnungsfaktoren, die bei verschiedenen Formen der Bluterkrankheit eingesetzt werden, oder Wachstumsfaktoren, auf die beispielsweise Dialysepatient*innen angewiesen sind.
Oder es sind bestimmte Enzyme, deren Fehlen auch die Ursache verschiedener lysosomaler Speicherkrankheiten ist. Bei all diesen Arzneimitteln handelt es sich ausnahmslos um „Nachbauten“ von Biomolekülen, genauer gesagt von Proteinen (Eiweißmoleküle), die so groß und kompliziert sind, dass sie chemisch nicht mehr zu synthetisieren sind. Sie lassen sich in aller Regel auch nicht aus dem Blut oder aus anderen natürlichen Quellen isolieren, denn selbst bei einem Gesunden sind diese hochaktiven Proteine nur in sehr geringen Konzentrationen vorhanden. So sind es nicht Chemiker, sondern Gentechnologen, die diese Wirkstoffe entwickeln.
Die DNA (Erbsubstanz) als universell verständlicher biologischer Informationsspeicher
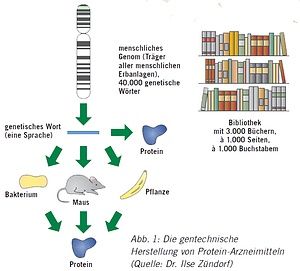
Während Chemiker*innen neue Moleküle in der Retorte oder im Reagenzglas „basteln“, lassen Gentechnolog*innen Moleküle von lebenden Zellen synthetisieren. Das ist möglich, weil die Information für diese Moleküle in der DNA so verschlüsselt ist, dass sie in jeder beliebigen Zelle in jedem beliebigen Lebewesen eindeutig verstanden wird. Anders als die vielen verschiedenen Sprachen auf dieser Erde kennt die Biologie auf der DNA-Ebene nur eine einzige Sprache. Dabei ist das Prinzip von Sprachen und Schrift ansonsten analog: Ebenso, wie wir ein Wort an der Abfolge ganz bestimmter Buchstaben erkennen, werden die Eigenschaften biologischer Moleküle durch „chemische Buchstaben“ erkannt, die ebenfalls in einer ganz bestimmten Reihenfolge (Sequenz) angeordnet sind. Drei Milliarden solcher Buchstaben sind im Zellkern einer jeden menschlichen Zelle enthalten. Das entspricht einer ganzen Bibliothek mit 3.000 Bänden, à 1.000 Seiten, à 1.000 Buchstaben. In diesen drei Milliarden Buchstaben sind ca. 40.000 genetische Wörter „versteckt“ (Abb. 1). Jedes genetische Wort entspricht einem Protein, und eine stattliche Anzahl dieser Proteine kann zu Medikamenten entwickelt werden, um Patient*innen zu helfen, denen das entsprechende Protein fehlt.
Was machen Gentechnolog*innen?
Die „Kunst“, die Gentechnolog*innen beherrschen, besteht darin, das genetische Wort für ein ganz bestimmtes Protein in der riesigen Bibliothek des menschlichen Genoms (Träger aller menschlichen Erbanlagen) zu finden, es dann zu isolieren und in die DNA einer anderen Zelle zu integrieren. So umgehen Gentechnolog*innen das oben geschilderte Problem, dass gerade die therapeutisch interessanten Proteine im Menschen nur in geringer Konzentration vorliegen. Hat man das genetische Wort eines Menschen in die Zelle eines Bakteriums, einer Hefe oder einer Säugerzelle integriert, so gelingt es mit ein paar zusätzlichen Tricks, beachtliche Mengen dieser wertvollen Wirkstoffe aus den Produktionszellen zu isolieren (Abb.1).
Am besten ist das Original?
Schaut man sich die heute zugelassenen gentechnisch hergestellten Arzneimittel an, stellt man fest, dass viele dieser Moleküle nicht den „Originalen“ entsprechen, sondern dass Modifikationen vorhanden sind, die die Gentechnolog*innen offensichtlich ganz gezielt eingefügt haben.
Warum sollte man so etwas tun?
Ein Problem beim therapeutischen Einsatz von Biomolekülen liegt darin, dass diese Moleküle eigentlich nur dann optimal funktionieren, wenn sie so in den Körper gelangen, wie dies die Natur vorsieht. Das ist bei Medikamenten aber nicht der Fall.
Insulin als Testfall für Wirkstoffoptimierung
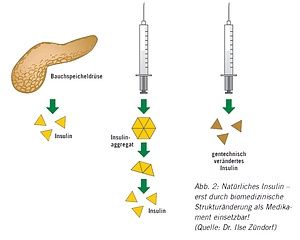
Beispielsweise kann man das Insulin, das ein Säuger-Organismus benötigt, wenn er mit Nahrung versorgt wird, nicht so fein dosiert dem Körper zuführen, wie dies die Bauchspeicheldrüse macht. Wir ziehen stattdessen eine große Menge Insulin in eine Spritze auf und spritzen es in eine Bauchfalte – im Extremfall so, dass es für den ganzen Tag ausreicht. Das ist alles andere als natürlich. Und für eine derart unnatürliche Applikation sind Biomoleküle keineswegs optimiert. Für Insulin bedeutet dies, dass das Hormon bei sehr hohen Konzentrationen, wie sie in einer Spritze vorliegen, „verklumpt“ und Komplexe bildet, in denen sechs einzelne Insulin-Moleküle zusammengeschlossen sind. In Form dieser Komplexe kann Insulin aber nicht wirken. Nur ein einzelnes Insulin-Molekül kann an den entsprechenden Rezeptor binden. Daher müssen wir den „Klumpen“ nach dem Spritzen im Gewebe die Zeit geben, zu einzelnen Molekülen zu zerfallen, weshalb gut geschulte Diabetiker*innen wissen, dass sie ca. eine halbe Stunde vor dem Essen Insulin spritzen sollen, um den Insulinkomplexen Zeit zum „Zerfallen“ zu geben. Dann müssen sie aber auch wirklich essen, denn zu viel Insulin im Körper ist genauso gefährlich wie zu wenig Insulin.
Dies führt zu einer erheblichen Einschränkung der Lebensqualität. Nach vielen Experimenten haben Gentechnolog*innen für dieses Problem clevere Lösungen gefunden: Durch kleine Änderungen an der Struktur des Insulins ist es gelungen, die unerwünschte Komplexbildung zu unterbinden. Die entsprechenden Varianten sind Insuline, die sofort nach dem Spritzen zu wirken beginnen. Diabetiker,*innen die diese Insuline verschrieben bekommen, können zu jeder Zeit essen. Kurz vor oder unmittelbar nach den Mahlzeiten spritzen sie dann die erforderliche Dosis des schnell wirksamen Insulins. Da der Organismus aber immer eine gewisse Insulinmenge benötigt, wurden auch Insuline entwickelt, die besonders lange wirken. Auch hier wurde die Struktur des biologischen Originals leicht verändert. Durch die Kombination von schnell und lang anhaltend wirkenden Insulinen werden Diabetiker*innen viel optimaler mit dem fehlenden Hormon versorgt, als das mit natürlichem Insulin möglich war. Daher ist abzusehen, dass die gefürchteten Spätfolgen einer schlecht eingestellten Diabetes deutlich zurückgehen werden (Abb. 2).
Nebenbei gesagt sind gentechnisch produzierte Proteine auch sehr viel sicherer als die analogen Proteine, die man früher direkt aus dem Menschen isoliert hat. Denn Krankheitserreger wie Hepatitis-Viren, HIV oder Erreger der Creutzfeldt-Jakob-Krankheit, die für den Menschen relevant sind, kommen bei Bakterien, Hefen oder den verwendeten Zelllinien gar nicht vor. Restrisiken, über die vor einigen Jahren Patient*innen noch aufgeklärt wurden, als Medikamente eingesetzt wurden, die beispielsweise aus Blut, Plazenta oder anderen Organen isoliert wurden, existieren bei gentechnisch hergestellten Medikamenten nicht mehr!
Qualität ist das Wichtigste!

Im Juli 2005 hat der amerikanische Präsident George W. Bush Henri Termeer, dem damaligen CEO (Chief Executive Officer) von Genzyme die „National Medal of Technology“ überreicht. Dieser höchste vom US-Präsidenten vergebene Preis für technologische Innovationen wurde Genzyme verliehen für „die Pionierleistungen in einem einzigartigen Geschäftsfeld, das zur erheblichen Verbesserung der Gesundheit von Tausenden von Patient*innen mit seltenen Erkrankungen beigetragen hat sowie für die Nutzbarmachung der Biotechnologie zur Entwicklung neuer innovativer Therapien“.
Mit dieser Medaille werden Persönlichkeiten und Unternehmen geehrt, die zum Wohlergehen des Staates in wirtschaftlicher, umweltorientierter und sozialer Weise in großem Maße beigetragen haben.
Wie und warum die Produktion dieser Innovationen, wie z. B. Therapeutika für die Enzymersatztherapie, bei Genzyme so besonders ist, das fragten wir Dr. Luc Kupers (51) von Genzyme in Geel/Belgien. Er gibt einen Einblick in die hochkomplizierten Produktionsanlagen, die 2001 von Genzyme übernommen worden sind.
Ist es schwierig und kompliziert, Enzyme herzustellen? Was ist daran so besonders?
Ist es schwierig und kompliziert, Enzyme herzustellen? Was ist daran so besonders?
Kupers: Proteine, dazu gehören Enzyme, monoklonale Antikörper und Wachstumsfaktoren, sind hoch komplexe Moleküle, die nicht in großen Massen chemisch produziert werden können. Für die Herstellung von Proteinen werden lebende Organismen benötigt, die schwierig zu kontrollieren bzw. zu steuern sind, wie es z. B. bei chemischen Reaktionen der Fall ist. Hinzu kommt, dass nur spezielle lebende Organismen auch die benötigten speziellen Proteine produzieren können. Für unsere Medikamente können wir nur Mammalia-Zellen (Säugetierzellen) verwenden. Diese Zellen sind sehr empfindlich und wir müssen uns an strikte Vorschriften für den Umgang mit ihnen halten.
Sauerstoffkonzentrationen und Säuregrad des Mediums können z.B. die Aktivität und die Sicherheit der Zellen beeinflussen. Das heißt, die Qualität des gentechnisch hergestellten Proteins ist abhängig von der Qualität der Herstellung. Darüber hinaus sind Proteine sehr empfindlich. So werden unsere therapeutischen Proteine – genauso wie z. B. Proteine aus der Nahrung – im Magen verdaut. Aus diesem Grund und aufgrund ihrer hohen Empfindlichkeit lassen sich Enzymersatztherapeutika weder in Form von Tabletten produzieren noch verabreichen.
Können Sie uns bitte die Herstellung eines solchen Enzyms erläutern?
Kupers: Wir wollen ja ein ganz bestimmtes menschliches Protein herstellen. Deshalb werden die Säugerzellen mit dem Gen (Erbanlage) modifiziert, das die Informationen unseres gewünschten Proteins enthält. Dafür benötigen wir – beispielsweise – genau das Gen von einem gesunden Menschen, das dem Gen entspricht, das Patient*innen fehlt. Diese modifizierten – rekombinanten – Zellen fangen an, das Protein zu produzieren, das für die Behandlung der lysosomalen Speicherkrankheit gebraucht wird. Im Labor werden diese rekombinanten Zellen in kleinen Mengen zum Wachstum gebracht und anschließend in speziellen Behältnissen aufbewahrt. Das Wachstum der Zellen geschieht in einem Medium aus Zucker, Aminosäuren, Salzen und Wachstumsfaktoren. Diese Behältnisse sind sozusagen unser Depot – oder unsere Zell-Bank. Sie werden eingefroren und in flüssigem Stickstoff gelagert. Jedes Mal, wenn wir mit der Herstellung einer neuen Produktionseinheit beginnen wollen, brauchen wir dazu Zellen aus unserem Depot.
Damit die Zellen wieder aktiv werden, werden die Behälter unter kontrollierten Bedingungen aufgetaut. Sie vermehren sich dann in unterschiedlichen Schritten von anfänglich ein paar Millionen bis zu ca. 30 bis 60 Milliarden Zellen. Diese angezüchteten Zellen kommen im nächsten Schritt im eigentlichen Produktionsbereich der Anlage in Bioaufbereitungsanlagen aus Edelstahl; nach zwei bis drei Tagen weiteren Wachstums geht es weiter in eine noch größere Anlage und dann in die endgültige große Produktionsanlage. Dort vermehren sie sich weiter, bis die maximale Menge erreicht ist. Danach wird das Protein in verschiedenen Schritten gereinigt, bis wir die hochreine Substanz haben, die wir haben wollen. Anschließend werden die Produkte in speziellen Behältern zu Sanofi in Waterford/England transportiert.
Welche speziellen Labors, Einrichtungen und Geräte sind dafür erforderlich?
Kupers: Sterilität hat oberste Priorität! Sterilität ist die allerwichtigste Voraussetzung für die Enzym-Produktion. Die Flüssigkeit, in der die Zellen wachsen, ist sehr anfällig für Verunreinigungen durch Bakterien. Bakterien vermehren sich in der Regel um ein Vielfaches rascher als die in der Produktion befindlichen Zellen und würden unsere gesamte Produktion zerstören. Deshalb sind unsere Geräte und Einrichtungen mit speziellen Beschichtungen versehen, die sie absolut steril halten. Einige ganz besondere Apparaturen, die das Wachstum der sehr empfindlichen Zellen kontrollieren, ohne sie dabei zu beschädigen, mussten extra für unsere Bedürfnisse entwickelt und produziert werden. Die extreme Reinheit der Proteine ist unbedingt erforderlich, weil sie als Infusion verabreicht werden.
Der Reinigungsprozess für Proteine erfordert hochwertige Lösungsmittel mit ganz speziellen bindenden Inhaltsstoffen, die in verschiedenen Edelstahlbehältern gelagert werden. Eine Abfolge von derartigen Behältern mit unterschiedlichen Eigenschaften und Filteranlagen garantiert das absolut reine Protein. Letztendlich mussten hier in Geel 130 Mio. Euro investiert werden, um überhaupt die Kapazität zu bekommen, die für die Produktion des spezifischen Enzyms für Morbus Pompe erforderlich ist.
Können Sie die Produktionsmengen im Voraus planen und dann die Präparate lagern?
Kupers: Jeder Produktionsprozess erfordert eine sorgfältige Bedarfsplanung. Das gilt selbstverständlich auch für alle von Sanofi produzierten Präparate und dementsprechend muss der Herstellungsprozess genau geplant werden.
Biotechnologie in der Medizin

„Wir verfügen heute über rund 200 biotechnologisch hergestellte Wirkstoffe“, sagt Prof. Dr. Theo Dingermann von der Goethe-Universität in Frankfurt und beschreibt die Biotechnologie in der Medizin somit als Erfolgsstory. „Manche Erkrankungen, z. B. lysosomale Speicherkrankheiten, wurden erst mit Hilfe der Biotechnologie behandelbar", ergänzte Dr. Thomas Sauer, bei Sanofi verantwortlich für die Industrialisierung neuer biotechnologischer Produkte. Beide Experten sprachen auf der Veranstaltung „Biotechnologie im Dialog" im Industriepark Höchst.
Doch was genau ist Biotechnologie? Ein Beispiel: Ursprünglich wurde Insulin, das für die Behandlung der Zuckerkrankheit benötigt wird, aus Bauchspeicheldrüsen von geschlachteten Schweinen gewonnen. Bei der biotechnologischen Herstellung hingegen bauen Wissenschaftler das Gen für Insulin in Zellen ein, die in einem Nährmedium wachsen. In der Folge vermehren sich die Zellen und produzieren Insulin. Vor 30 Jahren war Human-Insulin das erste biotechnologisch hergestellte Arzneimittel der Welt.
Komplexe Produktionsprozesse
Wie der Körper bei einem Zuckerkranken kein Insulin herstellen kann, so ist er bei lysosomalen Speicherkrankheiten nicht in der Lage, bestimmte Enzyme zu produzieren. Genzyme hat Verfahren entwickelt, diese humanen Enzyme biotechnologisch herzustellen. Vielschichtige Prozesse sind laut Sauer erforderlich, um solch hochkomplexe Moleküle wie die Wirkstoffe für die Enzymersatztherapie herzustellen. „Wir arbeiten so weit wie möglich in geschlossenen Systemen (vgl. Abbildung). Damit wollen wir die Produktionsbedingungen konstant halten und eine gleichbleibende Qualität gewährleisten", beschrieb Sauer die Herausforderungen der Produktion.