Die Stoffwechselkrankheit Morbus Gaucher (Gaucher-Krankheit) – Symptome, Diagnostik, Therapie
Was ist Morbus Gaucher?
Morbus Gaucher (häufig auch als M. Gaucher abgekürzt) ist eine erbliche Stoffwechselkrankheit, bei der Vergrößerungen der Milz und/oder der Leber, Veränderungen des Blutbildes sowie Knochenschmerzen auftreten. Die Gaucher Krankheit ist selten und tritt bei ungefähr einem von 40.000 bis 60.000 Menschen auf. Manche Patient*innen zeigen nur einen Teil der Symptome.
Ursache des M Gaucher ist ein Mangel an dem Enzym beta-Glukozerebrosidase. Weil es bei Gaucher Patient*innen nicht in ausreichender Menge vorhanden bzw. nicht ausreichend aktiv ist, sammelt sich ein ungespaltenes Stoffwechselprodukt (Glukozerebrosid) im Körper an und verursacht zunehmend Probleme. Dies geschieht in den Recycling-Zentren der Zellen, den Lysosomen. Deshalb wird Morbus Gaucher zu den sogenannten lysosomalen Speicherkrankheiten gezählt.
Bei Verdacht auf Morbus Gaucher sollten Patient*innen einen/eine Ärzt*in ihres Vertrauens aufsuchen. Es existieren derzeit zwei grundsätzliche Therapieprinzipien, mit denen die Krankheit zwar nicht geheilt, aber ursächlich behandelt werden kann.
Rosenbloom BE, Weinreb NJ. Crit Rev Oncog 2013; 18: 163-175
Linari S et al. Clin Cases Miner Bone Metab 2015; 12: 157-164
Mistry PK et al. Mol Gen Metab 2017; 120: 8-21
Auf dieser Website können Sie speziell auf Ihre Bedürfnisse zugeschnittene Informationen anfordern bzw. abrufen. Wählen Sie dafür bitte aus:
1. Welche Symptome treten bei Morbus Gaucher auf?
1.1 Was sind die häufigsten Symptome bei Morbus Gaucher?
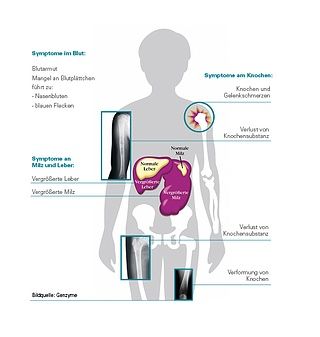
Die Mehrheit der Gaucher Patient*innen erkrankt bereits als Kind oder Jugendlicher/Jugendliche; bei etwa jedem/jeder dritten Betroffenen wird die Erkrankung jedoch erst im Erwachsenenalter festgestellt. Häufig sind die Organe Milz und Leber betroffen, nur selten die Lunge. Daneben treten Veränderungen im Blutbild auf, und auch die Knochen sind häufig betroffen. Die Morbus Gaucher Symptome können bei allen Patient*innen etwas unterschiedlich ausfallen – dementsprechend ist der Verlauf bei dem/der einzelnen Patient*in für die Medizin schwer vorherzusagen.
- Leber und Milz vergrößert: Bei der überwiegenden Mehrheit der Patient*innen tritt eine Milzvergrößerung und bei knapp zwei Dritteln eine Lebervergrößerung auf. Ein Zeichen dafür können ein dicker oder geschwollener Bauch oder ein dicker Oberbauch sein. Die vergrößerte Leber und Milz können zu einem Druckgefühl im Oberbauch führen und auch Ursache für ein Völlegefühl, Appetitverlust oder Übelkeit sein. Manche Patient*innen berichten, dass sie sich kurzatmig fühlen. Ein dicker Bauch bei Kindern bzw. ein aufgeblähter Bauch bei einem Kleinkind ist für Morbus Gaucher typisch.
- Verminderte Blutplättchen und Blutarmut: Bei vielen Patient*innen mit Morbus Gaucher ist die Zahl der Blutplättchen (Thrombozyten) im Blut erniedrigt. Dies kann sich in häufigem Nasenbluten, Zahnfleischbluten, in einer verstärkten Periode und einer Neigung zu blauen Flecken äußern.
Bei etwa jedem/jeder dritten Gaucher Patient*in liegt der Wert des roten Blutfarbstoffs Hämoglobin (Hämoglobinwert) unterhalb des Normbereiches – Ärzt*innen sprechen von einer Blutarmut (Anämie). Typische Symptome von Blutarmut sind Müdigkeit, Konzentrationsschwäche, Energiemangel und geringe Ausdauer. Sie kann auch Kurzatmigkeit zur Folge haben. Bei manchen Patient*innen ist zusätzlich die Zahl der weißen Blutkörperchen niedrig, bzw. deren Funktion beeinträchtigt. Weil sie für die Immunabwehr zuständig sind, können dann häufige Infekte/Infektionen auftreten. - Knochenschmerzen: Über Schmerzen der Knochen berichtet etwas weniger als die Hälfte der Patient*innen. Bei wenigen treten sogenannte Knochenkrisen auf – starke, über einige Tage anhaltende Knochenschmerzen. Wenn man Gaucher-Patient*innen mit sogenannten bildgebenden Verfahren, wie zum Beispiel dem Röntgen, untersucht, findet man bei mehr als acht von zehn Patient*innen vielfältige Schädigungen der Knochen. Unter anderem kann auch die Knochendichte verringert sein.
Ein Name – mehrere Krankheitstypen: 94% aller Gaucher Patient*innen sind an Morbus Gaucher Typ 1 erkrankt – deshalb geht es auf dieser Website ausschließlich um diese häufigste Form des M. Gaucher. Bei den Typen 2 und 3 ist zusätzlich zu den beschriebenen Symptomen auch das Nervensystem betroffen. Sie werden auf dieser Website nicht behandelt.
1.2 Frühe Anzeichen im Kinder- und Jugendalter
Wenn bereits ein Kind an Morbus Gaucher erkrankt, ist das häufig auffälligste der Morbus Gaucher Symptome meist der dicke, aufgeblähte Bauch. Ursache ist die stark vergrößerte Milz bei Kindern. Die Lebervergrößerung ist meist weniger ausgeprägt. Im Blut können die Zahl der Blutplättchen und Hämoglobinwert erniedrigt sein. Ein Teil der Kinder klagt über Knochenschmerzen. Die Gaucher-Krankheit kann Wachstumsverzögerungen verursachen, typischerweise setzt die Pubertät verspätet ein.
1.3 Symptome im Erwachsenenalter
Die Morbus Gaucher Symptome im Erwachsenenalter entsprechen weitestgehend denen im Kindesalter: vergrößerte Milz und Leber, niedrige Zahl der Blutplättchen und Hämoglobinwert, Knochenveränderungen. Anders als bei Kindern äußern sich die vergrößerten Organe hier allerdings eher in Beschwerden im Oberbauch und weniger durch einen aufgeblähten Bauch.
Rosenbloom BE, Weinreb NJ. Crit Rev Oncog 2013; 18: 163-175
Linari S et al. Clin Cases Miner Bone Metab 2015; 12: 157-164
Charrow J. et al. Arch Intern Med 2000; 160: 2835-2843
Goker-Alpan O et al. Mol Genet Metab. 2011; 104: 438-447
Auf dieser Website können Sie speziell auf Ihre Bedürfnisse zugeschnittene Informationen anfordern bzw. abrufen. Wählen Sie dafür bitte aus:
2. Was sind die Ursachen von Morbus Gaucher
M. Gaucher gehört zu den erblichen Stoffwechselerkrankungen. Die Ursache ist ein Mangel an dem Enzym beta-Glukozerebrosidase. Die Aufgabe dieses Enzyms ist es, ein Stoffwechselprodukt namens Glukozerebrosid in zwei Komponenten zu spalten, die dann im Körper weiterverwendet werden können. Weil dieser Vorgang bei Gaucher Patient*innen nicht ausreichend funktioniert, sammelt sich Glukozerebrosid an und verursacht zunehmend Probleme. Dies findet in den Recycling-Zentren der Zellen, den Lysosomen, statt. Deshalb wird Morbus Gaucher zu den sogenannten lysosomalen Speicherkrankheiten gezählt.
Die Zellsorte, die hauptsächlich von der Anhäufung des Speichermaterials betroffen ist, sind die Fresszellen (Makrophagen). Durch die übermäßige Speicherung schwellen sie zu sogenannten „Gaucher-Zellen“ an und reichern sich vor allem in Milz, Leber und Knochenmark an, wo sie zu den Symptomen der Gaucher-Erkrankung führen.
2.1 Vererbung bei Morbus Gaucher
Morbus Gaucher ist erblich, d.h. dass die Erkrankung von den Eltern auf ihre Nachkommen (Töchter und Söhne) weitergegeben wird. Das funktioniert so: Jeder Mensch erbt von jedem Gen zwei Kopien von seinen Eltern – eine von der Mutter und eine vom Vater. Das gilt auch für das Gen, das den Bauplan für das Enzym beta-Glukozerebrosidase enthält, also das Enzym, das bei Morbus Gaucher nicht ausreichend funktioniert.
- Sind beide Gene, die ein Mensch vererbt bekommen hat, fehlerfrei, dann produziert sein Körper aktives, voll funktionsfähiges Enzym – der Mensch ist gesund.
- Ist eines der beiden Gene fehlerhaft (enthält einen Gendefekt), erkrankt der betreffende Mensch selbst nicht, weil er noch das andere fehlerfreie Gen besitzt. Er kann das fehlerhafte Gen aber an seine Nachkommen weitergeben, wenn er selbst Kinder bekommt. Er ist daher Träger der Erkrankung.
- Wenn beide Gene fehlerhaft sind, kann nicht ausreichend aktives Enzym hergestellt werden und die Gaucher Erkrankung bricht aus.
Wie hoch das Erkrankungsrisiko für Morbus Gaucher eines geplanten Kindes ist, hängt also davon ab, welche Gene die Eltern tragen. Das Geschlecht spielt dabei keine Rolle, weder das der Eltern noch das des Kindes. Einen Überblick über die Genetik gibt die folgende Tabelle:
Wie hoch ist die Wahrscheinlichkeit, dass ein Kind an Morbus Gaucher erkrankt?
| Eltern | Kind |
Wahrschein- lichkeit | Genkopien des Kindes |
|---|---|---|---|
| beide Elternteile sind an Morbus Gaucher erkrankt (beide Elternteile tragen 2 fehlerhafte Gene) | erkrankt | 100% | 2 fehlerhafte Gene |
|
ein Elternteil ist erkrankt (2 fehlerhafte Gene), ein Elternteil ist Träger (1 fehlerfreies und ein fehlerhaftes Gen) |
erkrankt --------------- gesund |
50% -------------- 50% |
2 fehlerhafte Gene --------------- 1 fehlerfreies und 1 fehlerhaftes Gen (Kind ist Träger) |
|
ein Elternteil ist erkrankt (2 fehlerhafte Gene), ein Elternteil ist gesund (2 fehlerfreie Gene) | gesund | 100% |
1 fehlerfreies und 1 fehlerhaftes Gen (Kind ist Träger) |
| beide Elternteile sind Träger (beide tragen je 1 fehlerfreies und 1 fehlerhaftes Gen) |
erkrankt --------------- gesund |
25% --------------- 75% |
2 fehlerhafte Gene --------------- 1 fehlerfreies und 1 fehlerhaftes Gen (Kind ist Träger) (50%) --------------- 2 fehlerfreie Gene (25%) |
|
ein Elternteil ist Träger (1 fehlerfreies und 1 fehlerhaftes Gen), ein ist Elternteil gesund (2 fehlerfreie Gene) | gesund | 100% |
1 fehlerfreies und 1 fehlerhaftes Gen (Kind ist Träger) (50%) --------------- 2 fehlerfreie Gene (50%) |
| beide Elternteile sind gesund (beide Elternteile tragen 2 fehlerfreie Gene) | gesund | 100% | 2 fehlerfreie Gene |
Generell sollte bei allen genetischen Erkrankungen zusammen mit dem/der Ärzt*in ein Stammbaum der Familie erstellt werden. Dadurch besteht die Chance, weitere möglicherweise Betroffene zu erkennen. Die Ergebnisse können zudem wichtig für die Familienplanung weiterer Familienmitglieder sein.
Rosenbloom BE, Weinreb NJ. Crit Rev Oncog 2013; 18: 163-175
Linari S et al. Clin Cases Miner Bone Metab 2015; 12: 157-164
3. Morbus Gaucher Verdachtsfall
Wenn aufgrund der Symptome der Verdacht besteht, dass es sich um Morbus Gaucher handeln könnte, sollten Betroffene einen/eine Ärzt*in ihres Vertrauens aufsuchen und ihn/sie darüber informieren. Er/sie kann die nötigen Schritte für eine Diagnostik einleiten. Typischerweise wird er/sie zunächst die häufigeren Ursachen für die Symptome ausschließen. Spätestens, wenn sich dadurch keine Erklärung für die Beschwerden ergibt, ist es Zeit, auch an Morbus Gaucher zu denken.
Fachärzt*innen, die sich um Patient*innen mit vergrößerten Milzen und Blutbildveränderungen kümmern, sind Hämatolog*innen. Für Beschwerden im Oberbauch sind Gastroenterolog*innen die richtigen Ansprechpartner*innen; bei Kindern der/die Kinderärzt*in. Weil die Erkrankung so selten ist, haben viele Ärzt*innen die Erkrankung in ihrem Praxisalltag nicht immer auf dem Schirm. Deshalb müssen viele Patient*innen mit Morbus Gaucher mehrere Ärzt*innen aufsuchen, bis einer/eine die Symptome richtig deutet und die Diagnose stellt.
Mistry PK et al. Am J Hematol 2007; 82: 697-701
4.Wie wird Morbus Gaucher diagnostiziert?
Typisch für Morbus Gaucher sind Veränderungen im Blut, Organvergrößerungen und Schädigungen der Knochen. Deshalb wird der/die Ärzt*in meist folgende Untersuchungen vornehmen:
- Blutbild: Hiermit lassen sich Veränderungen im Blut sichtbar machen, z.B. eine Erniedrigung der Blutplättchen. Zusätzlich wird der/die Ärzt*in eine Analyse bestimmter Blutwerte im Labor veranlassen.
- Ultraschalluntersuchung: Mittels Ultraschall lassen sich die Vergrößerungen von Milz und/oder Leber messen.
- MRT: Mit der Magnetresonanztomografie können Veränderungen am Knochen sowie mögliche Knochenkomplikationen sichtbar gemacht werden.
- Morbus Gaucher Test: Deuten die Ergebnisse der genannten Untersuchungen auf eine Gaucher-Erkrankung hin, so lässt sich die Diagnose mit einem Bluttest durch den Nachweis einer verminderten Aktivität der beta-Glukozerebrosidase sichern.
Rosenbloom BE, Weinreb NJ. Crit Rev Oncog 2013; 18: 163-175
Linari S et al. Clin Cases Miner Bone Metab 2015; 12: 157-164
Auf dieser Website können Sie speziell auf Ihre Bedürfnisse zugeschnittene Informationen anfordern bzw. abrufen. Wählen Sie dafür bitte aus:
4.1 Morbus Gaucher Test
Mit dem Morbus Gaucher Test wird die Aktivität des Enzyms beta-Glukozerebrosidase im Blut bestimmt. Diese Tests sind heute als Trockenbluttests verfügbar. Dafür wird in der ärztlichen Praxis Blut abgenommen, aber nicht wie sonst üblich in Röhrchen an das Labor geschickt. Stattdessen werden einige Blutstropfen auf eine spezielle Filterkarte getropft und trocknen gelassen. Die Karte kann dann (in einem speziellen Umschlag) mit der Post an das Labor geschickt werden. Der Vorteil für die Praxis und den/die Patient*in: Es muss nicht extra ein zusätzlicher Termin für die Blutentnahme vereinbart werden, der auf die Kurierfahrten zum Labor abgestimmt ist.
Im Labor wird das Blut wieder aus der Karte herausgelöst, um mit modernen Verfahren zwei oder drei Tests durchzuführen:
- Enzymtest: Damit wird die Aktivität des der beta-Glukozerebrosidase bestimmt. Liegt sie unter dem Normwert, steht die Diagnose Morbus Gaucher zweifelsfrei fest.
- Lyso-GL1: Dieses Stoffwechselprodukt fällt bei M. Gaucher vermehrt an und erlaubt in der Regel eine gute Unterscheidung zwischen Anlageträger*innen und Betroffenen. Zudem kann er für die Verlaufskontrollen genutzt werden.
- Gentest: Zusätzlich ist es möglich, auch das Gen für die beta-Glukozerebrosidase zu analysieren, um zu untersuchen, ob ein Gendefekt vorliegt. Bei Patient*innen, deren Enzymaktivität im Grenzbereich zwischen normal und erniedrigt liegt, kann er Klarheit schaffen: Lässt sich ein Gendefekt nachweisen, steht die Diagnose Morbus Gaucher fest. Lässt sich keiner nachweisen, ist ein Gaucher ausgeschlossen. Aus wissenschaftlichem Interesse sowie für eine genetische Beratung wird der Gentest bei fast allen Patient*innen durchgeführt.
- Meist liegen die Testergebnisse innerhalb von ein bis zwei Wochen vor.
4.2 Häufige Fehldiagnosen
Das Leitsymptom des M. Gaucher – die vergrößerte Milz – kann viele verschiedene Ursachen haben. Diese werden auch als Differenzialdiagnosen bezeichnet. Weil die meisten infrage kommenden Erkrankungen häufiger sind als Morbus Gaucher, werden Ärzt*innen zunächst an diese wahrscheinlicheren Gründe für die Beschwerden – Lebererkrankungen, Leukämien, Infektionen und Autoimmunerkrankungen – denken. Eben weil sie ähnliche Symptome verursachen, sind diese Erkrankungen auch häufige Fehldiagnosen.
5. Therapie & Behandlung bei Morbus Gaucher
Die Erkrankung Morbus Gaucher kann behandelt werden. Für weitere Informationen wenden Sie sich gerne an Ihren/Ihre behandelnden/behandelnde Ärzt*in oder an ein Morbus Gaucher Kompetenzzentrum in Ihrer Nähe.
6. Besonderheiten im Alltag eines/einer Morbus Gaucher Patient*in
Dank der Therapie kommt die Mehrheit der Gaucher Patient*innen im Alltag und im Leben gut zurecht und sind durch die Krankheit wenig eingeschränkt, vor allem wenn die Erkrankung nicht früh erkannt wird. Das Symptome, das die meisten Probleme bereiten kann, sind die Knochenschädigungen, weil sie Schmerzen verursachen können. In einzelnen Fällen können hier orthopädische Operationen notwendig werden, wie beispielsweise der Einsatz einer künstlichen Hüfte. In diesem Zusammenhang kann das Thema Schwerbehinderung für Betroffene von Bedeutung sein. Mehr dazu können Sie hier im Bereich „Gesundheitspolitik“ nachlesen.
Noch mehr als gesunde Menschen sollten Betroffene daher gut auf sich Acht geben und auf ihren Körper hören. Das bedeutet: gesunde Ernährung, Erholungspausen einplanen bzw. bei Bedarf auch spontan einschieben und ausreichend Bewegung. Wichtig ist, die Therapie regelmäßig anzuwenden und die Kontrolluntersuchungen im Gaucher-Zentrum wahrzunehmen. Eine Schwangerschaft ist trotz Morbus Gaucher gut möglich, wie die Auswertung zahlreicher Erfahrungsberichte zeigt; sowohl die Schwangerschaft als auch die Therapie der Gaucher-Krankheit in dieser Zeit sollten von einem/einer Ärzt*in eng überwacht werden, der/die darin erfahren ist.
Wichtig zu wissen: Gaucher Patient*innen haben ein erhöhtes Risiko für bestimmte Tumorarten und für Morbus Parkinson. Sie sollten daher alle routinemäßigen Krebsvorsorgemaßnahmen in Anspruch nehmen.
7. Wie können sich Angehörige und Freund*innen von Morbus Gaucher Patient*innen informieren?
Die Mehrheit der Gaucher-Patient*innen kommt im Alltag gut klar, doch sind Belastbarkeit und Ausdauer möglicherweise nicht so hoch wie bei gesunden Menschen, und einem Teil der Patient*innen machen Knochenschäden zu schaffen. Dies sollten Angehörige und Freund*innen immer im Hinterkopf behalten und darauf Rücksicht nehmen, denn alle Menschen sind dankbar, wenn sie Unterstützung erfahren. Aber die wenigsten Patient*innen mit chronischen Erkrankungen wollen auf ihre Krankheit reduziert werden, sondern sie bleiben weiterhin die Menschen, die sie vor der Diagnose waren.
Generell gilt nicht nur für Patient*innen, sondern auch für Freund*innen und Angehörige: Wer Wissen über die Erkrankung hat, kann besser mit ihr und ihren Folgen umgehen. Sich zu informieren und offen miteinander umzugehen, ist deshalb von hohem Nutzen und kann möglichen Missverständnissen und unbegründeten Sorgen vorbeugen. Hilfreiche Informationen und Unterstützung bietet auch die Morbus Gaucher Selbsthilfegruppe. Auch unter dem Menü-Punkt „Mentale Gesundheit“ finden Patient*innen sowie Freund*innen und Angehörige umfangreiches Material.
8. Gibt es Morbus Gaucher spezialisierte Ärzt*innen?
Weil Morbus Gaucher eine seltene Krankheit ist, kennen sich nur wenige Ärzt*innen wirklich gut mit ihr aus. Solche Spezialist*innen findet man vorwiegend in sogenannten Kompetenzzentren, die sich meistens an Universitätskliniken befinden. Kompetenzzentren für Morbus Gaucher. Die Aufgabe von einem solchen Gaucher Zentrum oder Behandlungszentrum in der Klinik ist es, die Diagnose zu stellen (falls noch nicht geschehen) und gemeinsam mit dem/der Patient*in die für ihn geeignete Therapie auszuwählen. Die Betreuung und die kontinuierliche Behandlung erfolgen in Zusammenarbeit zwischen dem Gaucher-Zentrum und dem/der behandelnden Ärzt*in vor Ort.
Wichtig für Menschen mit M. Gaucher sind regelmäßige Kontrollen im Gaucher Zentrum. Hier werden vor allem das Blutbild, die Größe von Milz und Leber sowie die Knochen untersucht. Auch mit Hilfe von speziellen Biomarkern im Blut kann der/die Ärzt*in messen, wie gut die Therapie anschlägt. Wurde eine Therapie neu begonnen, sollten die Kontrolluntersuchungen im ersten Jahr am besten vierteljährlich und im zweiten Jahr halbjährlich erfolgen. Danach reicht bei stabilem Krankheitsverlauf eine Kontrolle pro Jahr.
Hinweis:
Die auf dieser Website befindliche Liste von spezialisierten Kliniken bzw. Zentren ist nicht abschließend. Bislang nicht aufgeführte Zentren können jederzeit ergänzt werden.
9. Morbus Gaucher Selbsthilfegruppe
Für viele Patient*innen mit Stoffwechselkrankheiten ist der Austausch mit anderen Betroffenen wichtig. Umfangreiche Informationen zur Selbsthilfe bietet die
Gaucher Gesellschaft Deutschland e.V
(Aktualisierung April 2021)
MAT-DE-2102078-1.0-04/2021
Viele interessante Informationen rund um die Erkrankung Morbus Gaucher finden Sie als Angehöriger der Fachkreise ab sofort neu auf „Campus Sanofi“.
(Aktualisierung Mai 2023)